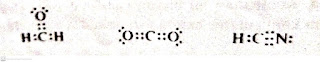Ikatan kovalen terbentuk karena adanya atom dengan keelektronegatifan yang sama atau hampir sama, sehingga menyebabkan tarikan yang sama atau hampir sama terhadap elektron ikatan. Jenis ikatan inilah yang disebut dengan ikatan kovalen polar.
Semakin elektronegatif suatu atom, maka akan semakin besar tarikan terhadap elektron ikatan , tarikannya tidak cukup bagi atom untuk memecahkan menjadi ion, tetapi cukup sehingga atom ini mempunyai bagian rapat elektron yang lebih besar.
Polarizabilitas atom atom menjadi faktor penentu derajat kepolaran suatu ikatan selain keelektronegatifan. Polarizabilitas merupakan kemampuan elektron untuk didistorsi (diubah bentuknya) sehingga mengimbas kepolaran.
Akibat perbedaan keelektronegatifan dan perbedaan Polarizabilitas adalah beranekaragam jenis ikatan. ikatan kimia dianggap sebagai suatu rangkaian kesatuan dari ikatan kovalen polar ke ikatan ion.
Momen Ikatan
Momen ikatan suatu ukuran kepolaran ikatan, dapat dihitung dari nilai gaya yang dialami oleh gaya tersebut. momen ikatan didefinisikan dalam e x d. Dengan e sebagai muatan (suatu elektrostatik) dan d adalah jarak antar muatan (dalam A), dan dilaporkan sebagai satuan yang disebut Debye (D).
Momen Dipol
Momen dipol adalah jumlah vektor dari momen ikatan dalam molekul. Karena adisi vektor menyangkut arah maupun besarnya momen ikatan, maka momen dipol adalah ukuran kepolaran molekul secara keseluruhan. Momen dipol dapat digunakan untuk membantu menentukan geometri molekul.
Tarikan Antar Molekul
- Antaraksi Dipol-Dipol
- Ikatan Hidrogen